Madde Nedir?
Uzayda yer kaplayan tanecikli yapılara madde denir. Maddenin şekil almış haline de cisim denir. Örneğin, tahta bir madde iken tahtadan yapılmış bir masa cisimdir.
Kütle Nedir?
Bir parçacık ya da nesneyi oluşturan değişmez madde miktarına kütle denir. Kütle ile ilgili bilmen gereken bazı bilgileri aşağıda listeledik:
- Maddenin ortak özelliğidir.
- Kütle m harfi ile gösterilir.
- SI birimi kilogramdır(kg).
- Kütle eşit kollu terazi ile ölçülür.
- Temel ve skaler bir büyüklüktür.
- Bulunduğu ortamın sıcaklık ve basınç koşullarına göre değişiklik göstermez.
Kütle Ne ile Ölçülür?
Kütle, eşit kollu terazi ile ölçülür.
Hacim Nedir?
Maddenin uzayda kapladığı yere hacim denir. Hacim ile ilgili aşağıdaki bilgileri öğrenmen senin için faydalı olabilir:
- Maddenin ortak özelliğidir.
- Hacim V sembolü ile gösterilir.
- SI birimi metreküptür (m³) .
- Kenar uzunlukları 1 metre olan küpün hacmine birim hacim denir.
Maddelerin Sınıflandırılması
- Saf Maddeler
- Elementler
- Bileşikler
- Saf Olmayan Maddeler
- Homojen Karışımlar
- Heterojen Karışımlar
- Süspansiyon
- Emülsiyon
Saf Maddeler
Saf madde, kimyasal olarak saf, yalnızca bir türden oluşan ve diğer element veya bileşenler içermeyen maddeleri tanımlar. Saf maddeler, kimyasal olarak ayrıştırılamazlar. İki tür saf madde vardır:
- Elementler: Kimyasal olarak daha basit yapıya sahip olan ve tek bir tür atomdan oluşan maddelerdir. Örnekler arasında oksijen (O2), hidrojen (H2), altın (Au) ve karbon (C) bulunabilir.
- Bileşikler: İki veya daha fazla farklı elementin kimyasal olarak birleşmesiyle oluşan maddelerdir. Örnekler arasında su (H2O), tuz (NaCl), karbon dioksit (CO2) ve amonyak (NH3) bulunabilir.
Örneğin, saf su (H2O) bir bileşiktir çünkü sadece hidrojen ve oksijen atomlarından oluşur ve başka herhangi bir madde içermez. Altın (Au) ise bir elementtir, çünkü sadece altın atomları içerir ve başka bir elementi veya bileşeni barındırmaz.
Elementler
Bir element, kimyasal olarak daha basit olan ve sadece bir tür atomdan oluşan saf bir madde türüdür. Her element, kimyasal sembolü ile temsil edilir. Örneğin, hidrojenin kimyasal sembolü “H”, oksijenin ise “O” şeklindedir. İşte bazı elementler ve kimyasal sembollerinin örnekleri:
- Hidrojen (H)
- Oksijen (O)
- Karbon (C)
- Demir (Fe)
- Altın (Au)
- Gümüş (Ag)
- Helyum (He)
- Nitrojen (N)
Her element, belirli bir atom numarasına sahiptir ve bu atom numarası, bir elementin kimliğini belirleyen temel bir özelliktir.

Bileşikler
Bir bileşik, iki veya daha fazla farklı elementin kimyasal olarak birleşmesiyle oluşan bir madde türüdür. Bileşikler, belirli bir oranda ve belirli bir moleküler yapıda atomlardan oluşur. Örneğin:
- Su (H2O): Su, hidrojen (H) ve oksijen (O) elementlerinin birleşmesiyle oluşan bir bileşiktir. Bir su molekülü iki hidrojen atomu ve bir oksijen atomu içerir.
- Tuz (NaCl): Tuz, sodyum (Na) ve klor (Cl) elementlerinin birleşmesiyle oluşan bir bileşiktir. Bir tuz molekülü bir sodyum atomu ve bir klor atomu içerir.
- Metan (CH4): Metan, karbon (C) ve hidrojen (H) elementlerinin birleşmesiyle oluşan bir bileşiktir. Bir metan molekülü bir karbon atomu ve dört hidrojen atomu içerir.
Bileşikler, elementlerin belirli oranlarda birleşmesiyle oluştuğu için, kimyasal formül olarak adlandırılan belirli bir yapıya sahiptirler.
Saf Olmayan Maddeler
Saf olmayan maddeler, bir ya da daha fazla farklı türdeki maddeyi içeren maddelerdir. Bu maddeler, karışımlar olarak adlandırılır ve çeşitli elementlerin veya bileşiklerin belirli oranlarda bir araya gelmesiyle oluşur. Saf olmayan maddelerin iki türü vardır: heterojen karışımlar ve homojen karışımlar.
Homojen Karışımlar
Homojen karışımlar, içerdikleri bileşenlerin gözle ayırt edilemez olduğu karışımlardır. Bu tür karışımların içindeki farklı maddeler birbirine tamamen karışmıştır. Örneğin:
- Tuzlu su: Tuzlu su, sodyum klorür (NaCl) ile suyun homojen bir karışımıdır. Tuz su içinde tamamen çözünmüş durumda olduğundan gözle ayırt edilemez.
- Hava: Atmosferdeki hava, azot (N2), oksijen (O2), karbon dioksit (CO2) ve diğer gazların homojen bir karışımıdır. Bu gazlar atmosferde homojen bir şekilde dağılmıştır ve gözle ayırt edilemez.
Homojen karışımlar genellikle çözeltiler olarak adlandırılır, çünkü içerdikleri maddeler birbirine çok iyi çözünmüştür. Heterojen karışımlar ise gözle ayırt edilebilir farklı fazlara sahiptir.
Heterojen Karışımlar
Heterojen karışımlar, içerdikleri bileşenlerin gözle ayırt edilebilir olduğu karışımlardır. Bu tür karışımların içindeki farklı fazlar bariz bir şekilde görülebilir. Örneğin:
- Kum ve su karışımı: Bu karışımda, kum tanecikleri su içinde çözünmez ve gözle görülür bir şekilde karışımda ayrı bir faz oluşturur.
- Salata: Salata içindeki malzemeler (örneğin, yeşillikler, domates, salatalık) gözle ayırt edilebilir ve homojen bir karışım oluşturmazlar.
Süspansiyon
Süspansiyon, bir sıvı içinde katı taneciklerin asılı olduğu bir heterojen karışımdır. Bu katı tanecikler, sıvı içinde çözünmezler ve zamanla çökelme eğilimindedirler. Bu nedenle, süspansiyonlar genellikle belirli bir süre sonra katı ve sıvı fazları arasında ayrışma gösterir. Süspansiyonlar, homojen karışımlardan (çözeltilerden) farklıdır çünkü içerdikleri katı tanecikler gözle görülebilir.
Örnekler:
- Portakal suyu: Portakal suyu içindeki portakal parçacıkları sıvı içinde asılıdır. Zamanla, bu parçacıklar sıvıdan çöker ve altta bir tortu oluşturur.
- Çamur suyu: Suya çamur eklediğinizde, çamur tanecikleri su içinde süspansiyon oluşturur. Ancak, çamur zamanla çökelir ve suyun alt kısmında bir çamur tabakası birikir.
Emülsiyon
Emülsiyon, iki sıvının (genellikle yağ ve su) mekanik olarak karıştırılmasıyla oluşan bir karışımdır. Bu karışım, normalde birbirine karışmayan iki sıvının küçük damlacıklar halinde dağıldığı bir sistemdir. Emülsiyonlar genellikle bir emülgatör (örneğin, sabun) kullanılarak stabil hale getirilir.
Örnekler:
- Mayonez: Mayonez, yağ ve su emülsiyonuna bir örnektir. Yumurta sarısı ve sirke gibi emülgatörler kullanılarak yağ ve su karıştırılır, böylece karışım homojen bir şekilde kalır.
- Süt: Süt, su içinde yağ globüllerini içeren bir emülsiyondur. Sütteki yağlar, sıvı içinde küçük damlacıklar halinde dağılmış durumdadır ve homojen bir sıvı oluşturur.
Maddenin Halleri
Maddenin temel halleri katı, sıvı, gaz ve plazma olarak dört ana grupta sınıflandırılır. İşte bu dört halin özelliklerini karşılaştıran bir tablo:
| Özellikler | Katı | Sıvı | Gaz | Plazma |
|---|---|---|---|---|
| Tanım | Belirli bir şekli ve hacmi vardır. Parçacıklar sıkıca düzenlidir. | Belirli bir şekli yoktur, ancak belirli bir hacmi vardır. Parçacıklar birbirine daha serbestçe hareket eder. | Ne şekli ne de hacmi belirli değildir. Parçacıklar birbirinden uzak ve serbestçe hareket eder. | İyonlaşmış gazlardan oluşan yüksek enerjili bir durumdur. Elektriksel olarak iletken olabilir. |
| Parçacık Hareketi | Titreşim hareketi yaparlar, ancak genellikle sabit konumdadırlar. | Serbestçe akarlar ve birbirlerine çarparlar. | Hareketleri düzensiz ve kaotiktir. Parçacıklar birbirinden uzaktır. | Parçacıklar yüksek enerjiye sahiptir ve iyonlaşmış durumdadır. |
| Hacim | Belirli bir hacme sahiptir. | Belirli bir hacme sahiptir. | Hacmi değişebilir ve genellikle kabın içini doldurur. | Hacmi değişebilir ve genellikle kabın içini doldurur. |
| Şekil | Belirli bir şekle sahiptir. | Belirli bir şekle sahip değildir. Kabın içini doldurur. | Belirli bir şekle sahip değildir. Kabın içini doldurur. | Belirli bir şekle sahip değildir. |
| Yoğunluk | Genellikle yoğundur. | Daha düşük yoğunluktadır. | Düşük yoğunluktadır. | Düşük yoğunluktadır. |
| Basınç ve Sıcaklık Etkisi | Sıcaklık ve basınca karşı dirençlidir. | Sıcaklık ve basınca karşı biraz dirençlidir. | Sıcaklık ve basınca karşı duyarlıdır. | Sıcaklık ve basınca karşı duyarlıdır. |
| Moleküler Düzen | Düzenli bir moleküler yapıya sahiptir. | Moleküller düzensiz bir şekilde düzenlenmiştir. | Moleküller düzensiz bir şekilde düzenlenmiştir. | İyonlar düzensiz bir şekilde düzenlenmiştir. |
| Örnekler | Taş, demir, buz. | Su, sıvı petrol. | Hava, hidrojen gazı. | Güneş ve yıldızların içinde bulunabilir. |
Bu tablo, maddenin farklı hallerinin temel özelliklerini karşılaştırmak için bir referans sağlar. Unutmayın ki plazma, genellikle yüksek sıcaklıklarda ve iyonlaşma durumunda bulunan bir durumdur ve tipik olarak laboratuvar ortamlarında değil, yıldızların içinde veya özel şartlarda oluşur.
Maddedeki Değişimler
Maddedeki değişimler ikiye ayrılır:
- Fiziksel Değişmeler
- Kimyasal Değişmeler
Fiziksel değişimde maddenin sadece fiziksel özellikleri değişirken, kimyasal değişimde madde yeni bir kimyasal bileşime dönüşür.
Fiziksel Değişimler
Fiziksel değişim, maddeyi oluşturan temel kimyasal özelliklerde bir değişiklik olmaksızın, sadece maddeyi fiziksel olarak değiştiren bir süreçtir. Bu değişimlerde, madde bir başka forma geçebilir, ancak kimyasal bileşenleri değişmez. İşte bazı fiziksel değişim örnekleri:
- Donma: Suyu soğuttuğunuzda, sıvı su, katı bir form olan buz haline geçer. Bu durumda, suyun kimyasal bileşeni değişmez.
- Kağıdın Yırtılması: Kağıdı yırtmak, kağıdın fiziksel yapısını değiştirir, ancak kağıdın kimyasal bileşimi aynı kalır.
- Buharlaşma: Su ısıtıldığında buharlaşarak gaz haline geçer. Ancak, su molekülleri hala aynıdır; sadece fiziksel durumları değişir.

Kimyasal Değişimler
Kimyasal değişim, maddeyi oluşturan temel kimyasal özelliklerde bir değişiklikle karakterizedir. Bu tür değişimlerde, madde yeni bir kimyasal bileşime dönüşür. İşte bazı kimyasal değişim örnekleri:
- Demirin Paslanması: Demir, oksijen ve su ile reaksiyona girerek demir oksit (pas) oluşturur. Bu durumda, demirin kimyasal bileşimi değişir.
- Odunun Yanması: Odun, oksijenle reaksiyona girerek karbon dioksit ve su üretir. Yanan odunun kimyasal bileşimi değişir ve yeni bileşikler oluşur.
- Asit ve Bazın Reaksiyonu: Bir asit ve bir bazın reaksiyonu sonucunda tuz ve su oluşabilir. Bu, iki farklı maddeyi birleştirerek yeni bir kimyasal bileşim oluşturan bir kimyasal değişimi temsil eder.

Maddelerin Ortak Özellikleri
Maddenin ortak özellikleri şunlardır:
- Kütle
- Hacim
- Tanecikli yapı
- Boşluklu yapı
- Eylemsizlik
Kütle
Kütle, bir nesnedeki madde miktarıdır; cisimlerin barındırdıkları atom sayısına ve çeşidine bağlı olarak belirlenir. Çoğu zaman kilogram (kg) veya gram (g) birimiyle ölçülür. Kütle m harfi ile gösterilir. Temel ve skaler bir büyüklüktür.

Hacim
Bir madde tarafından kaplanan alanın büyüklüğünü ifade eder. Hacim birimi metreküp (m³) veya litre (L) olarak ölçülür. Hacim V sembolü ile gösterilir.

Tanecikli Yapı
Maddelerin atomlar, moleküller veya iyonlar gibi daha küçük parçacıklardan oluştuğunu gösterir. Tanecikli yapı, madde türüne bağlı olarak değişebilir.

Boşluklu Yapı
Maddenin iç yapısında boşluklar olabilir. Atomlar, moleküller veya iyonlar arasındaki boşluklar maddeyi oluşturan parçacıkların düzenini etkiler. Boşluklu yapı, madde türüne ve koşullara bağlı olarak değişebilir.
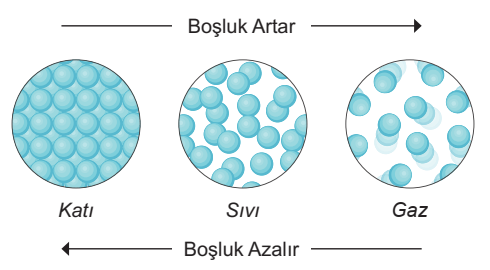
Eylemsizlik
Maddenin eylemsizliği, bir madde durumundaki bir cismin devam etme veya durma eğilimini ifade eder. Eylemsizlik, madde türüne ve hareket durumuna bağlı olarak değişir.

Maddelerin Fiziksel Özellikleri
- Esneklik
- Renk
- Koku
- Tat
- Sertlik
- Elektrik İletkenliği
- Isı İletkenliği
- Erime Noktası
- Kaynama Noktası
- Yoğunluk
- Çözünürlük
Maddelerin Kimyasal Özellikleri
- Yanma
- Paslanma
- Çürüme
- Asit ile Reaksiyon
- Baz ile Reaksiyon
Maddelerin Ayırt Edici Özellikleri
- Özkütle (Yoğunluk)
- Erime ve Kaynama Noktaları
- Çözünürlük
- Esneklik
- Genleşme Katsayısı
- Öz Isı
- İletkenlik
- Erime Isısı
Özkütle (Yoğunluk)
Maddenin birim hacmi başına düşen kütlesini ifade eder. Yoğunluk, d = m/v formülü ile hesaplanır.
Erime ve Kaynama Noktaları
- Erime Noktası: Bir madde katı halden sıvı hale geçerken, belirli bir sıcaklık değeridir.
- Kaynama Noktası: Bir madde sıvı halden gaz hale geçerken, belirli bir sıcaklık değeridir.
Çözünürlük
Bir madde için belirli bir çözücü içinde çözünme yeteneğidir.
Esneklik
Maddenin deformasyona uğradıktan sonra eski formuna geri dönebilme yeteneğine esneklik denir.
Genleşme Katsayısı
Maddelerin sıcaklık değişikliklerine karşı genleşme veya büzülme eğilimini ifade eder.
Öz Isı
Birim kütletin birim sıcaklık değişikliğine karşı ısı kapasitesine öz ısı denir.
İletkenlik
Maddenin elektrik veya ısıyı ne kadar iyi ilettiğini belirtir.
Erime Isısı
Bir maddeyi katı halden sıvı hale geçirmek için gerekli olan ısı miktarını ifade eder.
Dayanıklılık
Katı maddelerin dış kuvvetlere karşı şeklini korumak için gösterdiği direnç dayanıklılık olarak tanımlanır. Dayanıklılık kat sayısı maddeye, boyutuna ya da cisme göre değişiklik gösterir. Bu sebeple dayanıklılık kat sayısı ayırt edici bir özelliktir.
Katı cisimlerin dayanıklılığı kesit alanın hacmine oranı ile doğru orantılıdır. Dayanıklılığın matematiksel gösterimi aşağıdaki gibidir:
Dayanıklılık 𝛂 (Kesit Alanı/Hacim)
Katı cisimlerin dayanıklılığı kesit alanı ve hacimlerine bağlıdır.
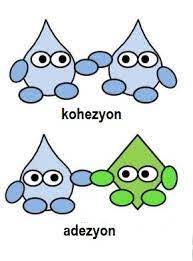
Adezyon ve Kohezyon
Farklı cins iki molekülün birbirine yapışmasını sağlayan çekim kuvvetine adezyon (yapışma) denir. Adezyon kuvveti büyüklüğü birbirine temas eden maddelerin cinsine bağlıdır. Günlük hayattan bazı adezyon örnekleri şöyle listelenebilir:
- Boyanın duvara yapışması
- Sıvıların bulundukları kabın şeklini alması
- Tozun evdeki mobilyalara yapışması
- Yağmur sonrası ev-araba camlarının ya da saçlarımızın ıslanması
- Bitkiler üzerindeki çiy damlaları
Aynı cins iki atomu ya da molekülü bir arada tutan çekim kuvvetine kohezyon (tutunma) denir. Kohezyon kuvveti maddelerin içerisindeki moleküler etkileşimlere bağlıdır. Kohezyon kuvveti moleküller arasındaki bağ kuvvetinin miktarına göre değişebileceği için madde cinsine göre değişiklik gösterir. Günlük hayattan bazı kohezyon örnekleri şöyle listelenebilir:
- Su damlalarının küresel yapıda dağılmadan durması
- Katıların sabit bir şekle sahip olması
- Gazlarda kohezyon kuvvetinin ihmal edilebilecek kadar az olması sebebiyle gazların belirli bir hacmi ya da şekli olmaması
Kohezyon kuvveti katılarda sırasıyla sıvılardan ve gazlardan büyüktür. Sıvıların kohezyon kuvveti de gazlardan büyüktür. Gazların ise ihmal edilecek kadar küçüktür. Katılar bu sayede sabit bir şekle ve hacme sahiptir. Sıvılar da kohezyon kuvveti etkisiyle belli bir hacme sahiptir. Gazların da sabit bir şekli ve hacmi yoktur. Kohezyon kuvvetinin büyüklüğü, katılara katı özelliğini, sıvılar ve gazlara akışkanlık özelliğini sağlar.
Yüzey Gerilimi
Sıvıların moleküller arası kohezyon kuvveti sebebiyle yüzey alanının esnek bir zar gibi davranmasına yüzey gerilimi denir. Yüzey gerilimi kohezyonun bir sonucudur.
Yüzey geriliminin klasik bir örneği, yaprak veya örümcek ağı gibi bir yüzey üzerinde şeklini koruyan su damlacıklarıdır. Su molekülleri arasındaki birleştirici kuvvetler, damlacığın yayılmasını engelleyen bir “deri” oluşturur. Sıvı moleküllerinin kendi aralarındaki çekim kuvveti (kohezyon) sıvı yüzeyine etki eden çekim kuvvetinden (adezyon) daha büyük olduğu için sıvı yüzeyi gergin bir deri gibi davranmaktadır. Kohezyon ve adezyon kuvvetleri arasındaki bu fark yüzey gerilimidir.
Her maddenin atomik ve bağ yapısı farklı olduğu için yüzey gerilimi de farklıdır. Sıvıların kendilerine ait yüzey gerilim katsayıları olmalarından da analayabileceğimiz gibi yüzey gerilimi ayırt edici bir özelliktir. Yüzey gerilimine etki eden faktörler şöyle listelenebilir:
- Sıcaklık ile yüzey gerilimi ters orantılıdır. Yani sıcaklık artıkça yüzey gerilimi azalır. Bildiğimiz gibi sıcaklık moleküllerin hareketliliğini arttırır. Bu durum moleküllerin birbirine tutunmasını zorlaştıracağından yüzey moleküllerinin birbirine çekilmesi de zorlaşır ve yüzey gerilimin azalması ile sonuçlanır.
- Sıvı yüzeyine etki eden gaz basıncı ile yüzey gerilimi ters orantılıdır.
- Sıvının içine sıvıda çözünmeyen başka bir sıvı eklendiğinde sıvının yüzey gerilimi azalır. Bunun sebebi sıvı moleküllerinin diğer sıvı molekülleriyle yaptığı etkileşim sonucu yüzeydeki moleküllerin kendi aralarındaki kohezyon kuvvetinin azalmasıdır.
- Sıvının yoğunluğu arttıkça yüzey gerilimi artar. Buna örnek olarak aynı yüzeye damlatılan su ve cıva damlalarından cıvanın daha küresel durması örnek verilebilir.

Kılcallık Olayı
Sıvı moleküllerinin temas halinde olduğu diğer maddenin molekülleri arasındaki çekim kuvvetinin (adezyon) sıvının kendi molekülleri arasındaki çekim kuvvetinden (kohezyon) büyük olması sonucu gerçekleşen etkiye kılcallık denir. Kılcallık olayı; adezyon, kohezyon ve sıvıların yüzey geriliminin toplu etkisinden kaynaklanır.
Madde ve Özellikleri Örnek Soru Çözümleri
1. Soru: Bir cismin yoğunluğu 800 kg/m³ ve hacmi 2 m³ ise, cismin kütle değeri nedir?
Çözüm: Kütle = Yoğunluk * Hacim
Kütle=800 kg/m³ × 2 m³ = 1600 kg
2. Soru: Bir su tankının hacmi 5 m³ ve suyun yoğunluğu 1000 kg/m³ ise, tanktaki suyun kütle değeri nedir?
Çözüm: Kütle = Yoğunluk * Hacim
Kütle=1000 kg/m ³× 5 m³ = 5000 kg
3. Soru: Bir cismin kütlesi 1200 kg ve yoğunluğu 600 kg/m³ ise, bu cismin hacmi nedir?
Çözüm: Hacim = Kütle / Yoğunluk
Hacim=1200 kg / 600 kg/m³ = 2 m³
4. Soru: Bir malzemenin yoğunluğu 850 kg/m³ ve hacmi 3.5 m³ ise, malzemenin kütle değeri nedir?
Çözüm: Kütle = Yoğunluk * Hacim
Kütle = 850 kg/m³ * 3.5 m³ = 2975 kg

