Periyodik Özellikler Soruları

Kimya
Periyodik Özellikler23
5. Na ve K elementleri için,
739
238/1
210127
1. Atom çapı: K>Na +
II. İyonlaşma enerjisi: Na>K
III. Son katmandaki elektron sayısı: K>Na
verilen karşılaştırmalardan hangileriyanlıştır?
(Atom numaraları: Na=11, K=19)
A) Yalnız III
D) II ve III
B) I ve II
E) I, II ve III
C) I ve Ill
eis Kimya Soru Bankası

Kimya
Periyodik Özellikler16)
1A 2A
4. periyot X
5. periyot Y
N
Yukarıdaki periyodik cetvelden alınan ke-
sitte yerleri gösterilen X, Y ve Z ile ilgili
aşağıdakilerden hangisi yanlıştır?
A) Metalik aktifliği en fazla olan Y'dir.
B) Çapları arasındaki ilişki Y>Z>X şeklindedir.
C) Elektropozitifliği en fazla olan Y'dir.
D) X ve Y'nin en büyük başkuantum sayıla-
ri aynıdır.
E) Üçü de küresel simetri özelliği gösterir.
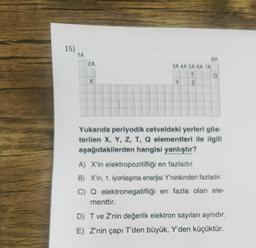
Kimya
Periyodik Özellikler15)
1A
2A
X
3A 4A 5A 6A 7A
T
Y
7
BA
Yukarıda periyodik cetveldeki yerleri gös-
terilen X, Y, Z, T, Q elementleri ile ilgili
aşağıdakilerden hangisi yanlıştır?
A) X'in elektropozitifliği en fazladır.
B) X'in, 1. iyonlaşma enerjisi Y'ninkinden fazladır.
C) Q elektronegatifliği en fazla olan ele-
menttir.
D) T ve Z'nin değerlik elektron sayıları aynıdır.
E) Z'nin çapı T'den büyük, Y'den küçüktür.

Kimya
Periyodik Özellikler9.
X elementinin 1. iyonlaşma enerjisi 128 kj/mol
iken ikinci iyonlaşma enerjisi 430 kj/mol'dür.
Elementin ikinci iyonlaşma enerjisinin bi-
rinci iyonlaşma enerjisinden yüksek olma-
sının nedeni;
1. Çekirdek yükünün artması
II. Elektron başına düşen çekim gücünün art-
masi
III. Çekirdeğin çekim gücünün artması
ifadelerinden hangileri ile açıklanabilir?
A) Yalnız I
B) Yalnız II
D) I ve III
C) I ve II
E) I, II ve III

Kimya
Periyodik Özelliklersey düzlemde, O merkezli
de, sabit süratle şekildeki gibi ok
adır.
Düşey
erkezcil kuvvetin büyüklüğü
3.5
L noktasına gelirken yer
cak üzerinde yaptığı iş
Knoktasına gelirken uçağa
merkezcil kuvvete eşittir.
ğrudur?
Dr.)
Biniz II
E) Il ye l
C) I ve Il
Paylaşım Yayınları
15.
Atom
yarıçapı
(A)
X
0,53
Kovalent
yarıçap
(Aº)
II.
0,37
Hidrojenin atom, kovalent, iyonik ve Van der Waals
yarıçapları yukarıdaki tabloda verilmiştir.
H₂
İyonik
yarıçap
(A)
Buna göre;
1. H₂ molekülündeki iki H atomunun çekirdekleri
arasındaki mesafe 0,74 Aº dur.
0,25
12
D) II ve III
Van der Waals
yarıçapı
(Aº)
1,20
H₂
gösterimindeki r₂ = 2,40 A° dur.
III. H₂ gazi H+ ve H-iyonlarına ayrıştığında birisinin
yarı çapı 0,53 A°, diğerinin yarıçapı 0,25 A° olur.
yargılarından hangileri dogrudur?
A) Yalnız I
B) Ive
E) I, II ve III
C) I ve lil
AYT/Fen Bilimleri
17.
Potansiyel enerji (kJ/mol)
1
X(g) +Y(g)
X(g) + Y(g) -
tepkimesine ait potansiyel ener
grafiğ 2 fark durum için yukar
Buna göre, aşağıdaki ifadele
doğrudur?
2
A) 1. durumda tepkimenin ent
büyüktür.
x
B) Aynı sıcaklıkta 2. durumda
daha büyüktür.
C) 1. durumdaki tepkimede
2. durum elde edilmiştir.
XE
D) 1. durumdaki tepkimenin
2. durumdakine göre dall
E) 1. ve 2. durumda tepkim
Oil. O
18. 25 °C de 0,1 M 100 mL HC
NH, sulu çözeltisi arasında

Kimya
Periyodik ÖzelliklerICI
-Orbital Yeyinlar!
5. Ametal atomları arasındaki elektronegatiflik farkı arttıkça
bağın polarlığı artar.
Atom Elektronegatiflik değeri
H
A) Amonyak
ZOF
N
2,1
2,5
3
Buna göre aşağıda verilen hangi iki atom arasında olu-
şacak bağın polarlığı en fazladır?
B) Su
D) Azot monoksit
3,5
4,0
C) Hidrojen florür
E) Metan

Kimya
Periyodik Özellikler2. Aşağıdaki periyodik tabloda X, Y ve Z elementlerinin yerleri
verilmiştir.
NX
re Kimyası
A) Yalnız I
Buna göre,
I. 1. iyonlaşma enerjisi en büyük olan element Y dir.
II. Atom yarıçapı en büyük olan element X tir.
III. Metalik aktifliği en büyük olan element Z dir.X
yargılarından hangileri doğrudur?
no B) Yalnız II
Y
D) II ve III
E) I, II ve III
C) Yalnız III

Kimya
Periyodik Özellikler9. Aşağıdaki tabloda verilen özellikler doğru ya da yanlış
oluşuna göre "0" ve "1" tam sayıları ile kodlanmıştır.
Özellik
Metal iyonu ile değerlik elektronları
arasındaki etkileşim metalik bağdır.
Bakır hem iyonik hem de kovalent
bağ oluşturabilir.
Kod
Buna göre,
1. Metallerde elektron verme isteği ile metalik
aktiflik ters orantılıdır.
D) 010
1
II. Ayni periyotta çekirdek yükü arttıkça metalik
sertlik artar.
III. Metallerde erime sıcaklığı ile metalik aktiflik
ters orantılıdır.
E) 101
0
ifadeleri sırasıyla aynı mantıkla kodlanırsa aşağı-
dakilerden hangisi elde edilir?
A) 111
B) 011
C) 110

Kimya
Periyodik ÖzelliklerCAP
5. Alkali metal oldukları bilinen X, Y ve Z atomları ile ilgi
Birinci iyonlaşma enerjisi en büyük olan Z'dir.
Y'nin çekirdek yükü, X'inkinden büyüktür.
.
bilgileri veriliyor.
Buna göre X, Y ve Z metallerinin aynı koşullardaki
erime noktalarının kıyaslanması aşağıdakilerden
hangisinde doğru verilmiştir?
A) X > Y>Z
B) Y>Z>X C) Y>X>Z
D) Z>X>Y E) Z> Y>X
e

Kimya
Periyodik Özellikler9.
X, Y, Z ve T element atomlarının periyodik özellikleriyle
ilgili aşağıdaki bilgiler verilmiştir.
1. iyonlaşma enerjisi en büyük olan X'tir.
Elektron ilgisi en büyük olan Y'dir.
Elektronegatifliği en büyük olan Z'dir.
Atom yarıçapı en büyük olan ise T'dir.
●
.
.
.
Buna göre, bu elementlerin periyodik tablodaki
yerleriyle ilgili,
I.
II.
III.
tablolarından hangileri doğru olabilir?
A) Yalnız I
B) Yalnız II
D) I ve II
E) I ve III
C) Yalnız III
11

Kimya
Periyodik Özellikler4. F₂, Cl₂, Br₂ ametallerinin elektron alma eğilimleri F₂ >
Cl₂> Br₂ şeklinde sıralanmaktadır. F- ve Br iyonları-
nın bulunduğu bir kaba Cl₂ gazı gönderiliyor.
Bu kapta;
1. Cl₂ +2e → 2C1-
II. 2Br Br₂ + 2e-
III. 2F- -
F₂ + 2e-
2
yukarıda verilen yarı tepkimelerden hangilerinin
gerçekleşmesi beklenir?
A) Yalnız I
D) I ve II
B) Yalnız II
C) Yalnız III
E) II ve III
LEKTROKİMYA
![D
11. İnşaatta temelden başlanarak üst katlara çıkıldığı gibi bir
atomun elektronları da düşük enerjili orbitallerden baş-
layarak yüksek enerjili orbitallere doğru yerleşir.
Enerji seviyesi
TO NO SO O
O 4p
III.
3s
A) Yalnız I
ooo
1s
D) I ve II
ooo
3p
Bir orbitale en fazla iki tane elektron yerleşebilece-
ğine göre;
OOO
2p
1. F atomunun 2. enerji düzeyindeki orbitallerine 7 ta-
ne elektron yerleşir. 1]
ooooo
3d
II. 24 Cr atomunun 3. enerji düzeyindeki orbitallerine 5
tane elektron yerleşir.
35
Br atomunun 4. enerji düzeyindeki orbitallerine 5
tane elektron yerleşir.
yargılarından hangileri doğrudur?
B) Yalnız II
E) I ve III
C) Yalnız III](https://media.kunduz.com/media/question/seo/raw/20230319071535391121-4876959.jpeg?w=256)
Kimya
Periyodik ÖzelliklerD
11. İnşaatta temelden başlanarak üst katlara çıkıldığı gibi bir
atomun elektronları da düşük enerjili orbitallerden baş-
layarak yüksek enerjili orbitallere doğru yerleşir.
Enerji seviyesi
TO NO SO O
O 4p
III.
3s
A) Yalnız I
ooo
1s
D) I ve II
ooo
3p
Bir orbitale en fazla iki tane elektron yerleşebilece-
ğine göre;
OOO
2p
1. F atomunun 2. enerji düzeyindeki orbitallerine 7 ta-
ne elektron yerleşir. 1]
ooooo
3d
II. 24 Cr atomunun 3. enerji düzeyindeki orbitallerine 5
tane elektron yerleşir.
35
Br atomunun 4. enerji düzeyindeki orbitallerine 5
tane elektron yerleşir.
yargılarından hangileri doğrudur?
B) Yalnız II
E) I ve III
C) Yalnız III

Kimya
Periyodik ÖzelliklerEtkinlik - 4
Aşağıdaki orbitallerin n ve & değerlerini bulunuz. Or-
bital enerjilerini büyükten küçüğe doğru sıralayınız.
n+l
Orbital
2s
3p
4s
3d
4f
6s
Modern Atom Teorisi
6p
n
2
MJM
SI
I
l
O
1
O
OWN
1
2
331
4
7
haet
Sıralaması;
bp) 4F) 65) 3d) (s) Jp 25

Kimya
Periyodik Özellikler86. Aynı periyotta bulunan X, Y, Z, T elementleri ile ilgili,
Çapı en büyük olan Z'dir.
• X'in değerlik elektronları s orbitalinde, Y'nin değer-
lik elektronları s ve d orbitallerindedir.
• T'nin iyonlaşma enerjisi en yüksektir.
bilgileri verilmektedir.
Buna göre, elementlerin atom numaralarına göre kı-
yası aşağıdakilerin hangisinde doğru verilmiştir?
A) Z>X>Y>T
C) X > Y>T> Z
B) T> Y>X>Z
D) Y>X>T> Z
E) Z>Y>T> X

Kimya
Periyodik Özellikler11./2. periyotta yer alan X, Y ve Z elementleri ile ilgili aşağıdaki
bilgiler veriliyor.
X elementi: Oda sıcaklığında katı hâlde olup ısı ve elektrik
akımını iyi iletir.
Y elementi: Moleküler yapıda bulunur.
Z elementi: Hiçbir element ile tepkimeye girmez.
Buna göre X, Y ve Z elementleri ile ilgili aşağıdaki yar-
gilardan hangisi yanlıştır?
(A) Xelementi metal, Y elementi ametal olarak sınıflandırılır.
BZ elementinin 1. iyonlaşma enerjisi en fazladır.
C) Xelementinin atom numarası, Y elementinin atom nu-
marasından küçüktür.
D) Z elementinin elektron ilgisi, Y elementinin elektron
ilgisinden fazladır.
E) Yelementinin atom yarıçapı, X elementinin atom yarı-
çapından küçüktür.

Kimya
Periyodik Özellikler8.
B) lyonlaşma enerjisi
C) Değerlik elektronlan sayısı
DY Degerlik elektronları sayısı
E) Atom çapı
Periyodik cetvelin 3. periyodunda bulunan X ve Y me-
tallerinden X 1A, Y 2A grubunda yer almaktadır.
Buna göre,
1.X in atom çapı Y ninkinden büyüktür.
II. Y nin 1. iyonlaşma enerjisi X inkinden büyüktür.
X in çekirdek yükü Y ninkinden küçüktür.
Atom çapı
İyonlaşma enerjisi
İyonlaşma enerjisi
yargılarından hangileri doğrudur?
A) Yalnız I
D) I ve II
B) Yalnız II
C) Yalnız III
E) I, II ve III
E)
eis MOD
ABCDE
100000
21
40
5
6
Y
180.
W
XO
XXX
Ond
xxn
noe
70
A
TEST ID:
