Tepkimelerde Isı Değişimi Soruları
Kimya
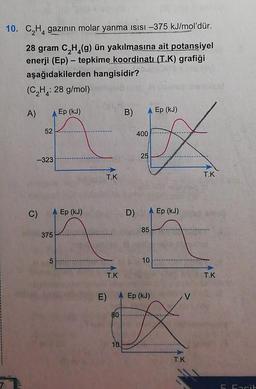
Tepkimelerde Isı Değişimi10. C₂H gazının molar yanma ısısı –375 kJ/mol'dür.
28 gram C₂H₂(g) ün yakılmasına ait potansiyel
enerji (Ep) - tepkime koordinatı (T.K) grafiği
aşağıdakilerden hangisidir?
(C₂H₂: : 28 g/mol)
A)
52
-323
C)
375
5
Ep (kJ)
Ep (kJ)
E)
T.K
T.K
B)
10
D)
400
25
85
10
Ep (kJ)
Ep (kJ)
Ep (kJ)
80
X
T.K
T.K
T.K
5. Facit

Kimya
Tepkimelerde Isı DeğişimiÖrnek 16
• CH₂OH() + O2(g) → CO2(g) + 2H₂O(a)
•
C(k) + O2(g) → CO2(g)
H₂(g) +21/200
Tepkimelerine göre;
C(k) +
+ O2(g) → H₂O(s)
121/1200
A) +880
02 (9)
D) -678
AH = +202 kJ/mol
AH = -393 kJ/mol
tepkimesindeki metil alkolün standart oluşum entalpisi (AH)
kaç kJ/mol'dür?
B) +476
AH = -285 kJ/mol
+ 2H2(g) → CH3OH(s)
1318
E) -1165
C) -476

Kimya
Tepkimelerde Isı DeğişimiÖrnek 15
S(k) + O2(g) → SO2(g)
SO2(g) +
2/1/20 O2(g) → SO3(g)
A)-790
AH = -297 kJ/mol
Standart koşullarda gerçekleşen yukarıdaki tepkimelere göre;
+302(g)
62SO3(g) →2S (k) +
tepkimesinin entalpisi (AH°) kaç kJ/mol'dür?
B) 790
AH° = -98 kJ/mol
C) 398
D) -398
E) 227

Kimya
Tepkimelerde Isı Değişimi932nd
-
4. H+(suda) + OH-(suda) → H₂O(s) + 60 kJ
tepkimesine göre, 200 mL 0,2 M H₂SO çözeltisi
ile 800 mL 0,4 M NaOH çözeltisi tepkimeye giriyor.
6 Buna göre, açığa çıkan ısı kaç joule olur?
B)-4800
C) 3200
A)-3200
418 D) 4800
418160
200
E) 6000
DA -
0,3
0,32

Kimya
Tepkimelerde Isı Değişimi47. X2(g) + Y2(g)
tepkimesinde X₂ ve Y₂ moleküllerinin kinetik
enerji - molekül sayısı grafiği aşağıda veril-
miştir.
-
Z(0)
Molekül sayısı
Ea
A
B
Bölgesi Bölgesi
Kinetik
Enerji
Buna göre;
1. B bölgesindeki taneciklerin yaptığı çar-
pışmalar ürüne dönüşebilir.
II. Sıcaklığı artırmak B bölgesindeki tane-
cik sayısını değiştirmez.
III. A bölgesindeki tanecikler etkin çarpış-
ma yapamaz.
yargılarından hangileri doğrudur?
(Ea: Aktifleşme Enerjisi)
A) Yalnız I B) I ve II
D) II ve III
C) I ve III
E) Yalnız III

Kimya
Tepkimelerde Isı Değişimi13. I. Bir gazın suda çözünmesi
II. Uyarılmış haldeki bir atomun temel hale gelmesi
III. Bir maddenin yanması
Yukarıda verilen olaylardan hangileri her zaman isi vere-
rek gerçekleşen bir değişimdir?
A) Yalnız I
D) I ve II
B) Yalnız II
E) II ve III
C) Yalnız III
EĞİŞİMİ

Kimya
Tepkimelerde Isı DeğişimiBileşik
SO2(g)
SO 3(g)
Buna göre,
A) +49
Standart oluşum entalpisi
(kJ/mol)
SO2(g) +
B) - 49
- 297
- 395
tepkimesinin entalpisi kaç kJ/mol dür?
1/1/02 (9)
O2(g) → SO
SO 3(g)
C) - 98
AH = ?
D) -395
E) -692

Kimya
Tepkimelerde Isı Değişimi3. CH2n+2 bileşiğinin standart koşullarda molar yanma en-
talpisi -2046 kJ dir. Yenma tep. oluatur.
2
CnH2n+2 CO₂ ve H₂O gazlarının molar oluşma ental-
pileri sırasıyla -104, -394 ve -242 kJ olduğuna gö-
re, C₂H₂n+2 bileşiğindeki n sayısı kaçtır?
A) 1
C) 3
DY4
E5
CnH₂n+2 +40₂cg₁ in C 0₂ + H₂0
a(n+1)
20+0+1
B) 2

Kimya
Tepkimelerde Isı Değişimi6. N₂ + 3H₂
2(g)
2(g)
2NH₂
tepkimesine göre,
A) Yalnız I
3(g)
I. NH, gazının potansiyel enerjisi N₂ ve H₂ gazlarının
toplam potansiyel enerjisinden büyüktür.
AH° = -46 kJ
II. NH, gazının standart oluşum entalpisi -23 kJ dür.
III. 0,4 mol NH, elde etmek için 9,2 kJ Isı gerekir.
yargılarından hangileri doğrudur?
D) II ve III
B) Yalnız II
C) I ve III
E) I, II ve III

Kimya
Tepkimelerde Isı Değişimi2(g)
+20,
2H₂O
(g)
tepkimenin potansiyel enerji - tepkime ilerleyişi o
Standart şartlarda gerçekleşen denklemi verile
fiği aşağıdaki gibidir.
Potansiyel enerji ((kj)
10.
X
S2
ter
32
CH4(9)
CO. +
2(g)
ulo miruss
Tepkimenin aktifleşme enerjisi 1000 kj olduğu
na göre,
Ea?
1. X değeri 900 kj'dir.
II. Y değeri - 100 kj'dir.
III. Z değeri - 900 kj'dir.
(-yon
Tepkime ISISI-800 kj'dir.
yargılarından hangileri doğrudur?
A) I ve II
Tepkime
ilerleyişil
CH4(g) için AH-100 kJ
CO₂ için AH = -400 kJ
2(g)
ol
H₂O için AH = -250 kJ
ol
B) I ve III
D) II, III ve IV
X-4 = 1000
000
C) I, II ve III
E) I, II, III ve IV

Kimya
Tepkimelerde Isı Değişimigiren + Endoters
III. CI atomları daha kararsız olmak için Cl, molekülünü
oba a
oluştururlar.
yargılarından hangileri doğru olur?
A ve ll
T, II ve III
2.
Bağ
X-X
Y-Y
(6)
A) Yalnız I
Bağ enerjisi
245 kJ/mol
473 kJ/mol
Byalnız III
II ve III
E) Yalnız I
Yukarıdaki verilere göre;
I. X₂ molekülünün oluşumu ekzotermiktir.
II. Y₂ → 2Y dönüşümü endotermiktir. +
2
D) II ve III
III. Y, molekülünün bağlarını kırmak için gereken ener-
2
ji X₂ ye göre daha fazladır. +
yargılarından hangileri doğrudur?
B) Yalnız III
C) I ve II
ginen
E) I, II ve III

Kimya
Tepkimelerde Isı Değişimiesti
Kimyasal Tepkimelerde Enerji - IX
PE (kkal)
20 X₂+Y₂
Grafiklerde,
X₂ + Y₂
2XY
2XY
T.K
X₂+2Y₂
P.E (kkal)
AH=+40kJ
80
→ 2XY ve XY + 2127
T.K
D) PE (kkal)
20
2XY
0
XY+1/2Y2
tepkimelerinin potansiyel enerji (P.E) - tepkime koordinatı (T.K) değişimi verilmiştir.
Buna göre aynı koşullarda,
+120
2XY₂ → X₂ + 2Y2
tepkimesinin P.E - T.K grafiği aşağıdakilerden hangisidir?
A) PE (kkal)
B) PE (kkal)
2XY
→ XY₂
XY₂
AH°=-60kJ
X₂+2Y₂
T.K
T.K
AH=-40kJ
X₂+2Y₂
T.K
E) PE (kkal)
2XY
C) PE (kkal)
2XY₂
X₂+2Y₂
AH²=-100kJ
X₂+2Y₂
AH*=+80kJ
T.K
T.K
59

Kimya
Tepkimelerde Isı DeğişimiAşağıda üç tepkimenin standart entalpi değişimi veril-
miştir.
CH₂OH(s) +
dir?
3
O2(g) → CO₂(g) + 2H₂O(s)
C(grafit) + O₂(g) → CO2(g)
H₂(g) + O₂(g) → H₂O(s)
2
Buna göre,
C(grafit) + 2H₂(g) + O₂(g) →→→ CH₂OH(s)
2
tepkimesinin standart entalpi değişimi (AH°) kaç kJ
A) +41
D) +245
AH°=-720 kJ
AH=-393 kJ
AH°= -286 kJ
B)-1685
E) -245
C) +1685
+720
393

Kimya
Tepkimelerde Isı Değişimi1. Gaz halin entalpisi en
yüksek, katı halin en
düşüktür.
Buna göre,
A(g) + B₂(g) →→
AB₂(g) + X KJ
A(k) + B₂(g) →
AB₂(g) + Y KJ
A(g) + B₂(g) →
AB₂(k) + Z kJ
tepkimeleri farklı fiziksel
hallerde gerçekleştiğin-
den X, Y ve Z değer-
lerinin kıyası Z>X > Y
şeklindedir.

Kimya
Tepkimelerde Isı Değişimieter
kkal
an HC
1.2
HO
mlerin
2. CO₂(g) + H₂(g) → CO(g) + H₂O(g) tepkimesinin
AH değerini hesaplayabilmek için;
CO(g) ve CO₂(g) nin oluşma ısıları
LH₂O(s) nin oluşma ısısı
III. H₂O(g) nin yoğunlaşma ısısı
değerlerinden hangileri gereklidir?
A) Yanız I
B) I ve II
DHI ve III
C) +ve Til
E) I, II ve III
1:
6.

Kimya
Tepkimelerde Isı Değişimi11. Asetik asitin (CH3COOH) molar yanma isisi-187 kkal,
CO₂ gazının molar oluşum ısısı -94 kkal, H₂O(g)nin
374
molar oluşum ısısı -58 kkal dir.
6
Jak
Buna göre, asetik asitin molar oluşum Isısı kaç
kkal dir?
A) -49
D)-35
B)-117
E) +35
2CH₂COOH + 9/2
C) -107
+92 →400₂
+
QH₂0
