Kimyasal Türler ve Etkileşimler Soruları

Kimya
Kimyasal Türler ve EtkileşimlerF CL B
fel
Flor, klor, brom ya da iyot olduğu bilinen X, Y, Z vet
elementlerinin hidrojen ile oluşturdukları HX, HY,HZ
ve HT bileşiklerinin aynı koşullardaki kaynama nokta
ları arasındaki ilişki HX > HZ > HT > HY şeklindedir
f
Buna göre,
1. Atom numarası en büyük olan element Zdir.
1 HX'in tanecikleri arasındaki etkin çekim kuy.
veti hidrojen bağıdır.
III. Aynı koşullarda elementlerin kaynama nokta-
ları arasındaki ilişki Z, > T2 > Y2>X, şeklinde-
dir.
yargılarından hangileri doğrudur? (H)
A) Yalnız! B) Yalnız II
C) Yalnız III
D) Il ve III E) I, II ve III

Kimya
Kimyasal Türler ve Etkileşimler1.
• Gömleğin iki yakasını bir araya getiren düğme
• Sevdiğini görünce sarılan bir insan
Bir yara üzerine konulan pansuman bezinin yerinde sabit
kalmasını sağlamak için kullanılançengelli iğne
Yukarıdaki günlük hayatımızdan verilen örnekler aşağı-
daki olaylardan hangisine benzetilebilir?
he
A Polar bir çözücü olan suyun içinde polar özellikteki etil
alkolün çözünmesi
B) Azot molekülünden azot atomlarının oluşması
CX Kuru buzun süblimleşmesi
ek
D) Suvun elektrolizinde H-O bağlarının kırılması
E) Katı taneciklerinin isitılmasıyla birbirinden uzaklaşması

Kimya
Kimyasal Türler ve Etkileşimler3
.
Molekül
London | Dipol-dipol Hidrojen
kuvveti etkileşimi bağı
1.
HBr
+
II.
CHOCHZ
+
+
+
III.
CCM
+
4
Yukarıdaki bileşiklerin hangilerinin molekülleri
arasında yoğun fazlarda oluşabilecek zayıf etki-
leşimler doğru olarak işaretlenmiştir?
(H, C, 0, CI, 35Br)
A) Yalnız 1 B) Yalnız 11 C) I ve II
6
17
D) I ve III
E) II ve III
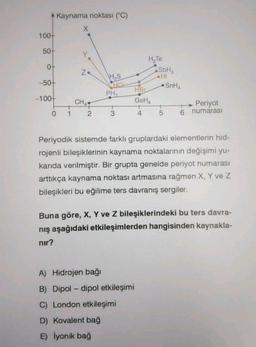
Kimya
Kimyasal Türler ve EtkileşimlerKaynama noktası (°C)
x
100+
50+
Y
0+
Za
Hs
-50+
HCL
PHA
H,
Te
SbH
HI
SnHA
HBC
GeH
Periyot
t
4 5 6 numarası
-100+
CHAR
0
1
2
3
Periyodik sistemde farklı gruplardaki elementlerin hid-
rojenli bileşiklerinin kaynama noktalarının değişimi yu-
karıda verilmiştir. Bir grupta genelde periyot numarası
arttıkça kaynama noktası artmasına rağmen X, Y ve Z
bileşikleri bu eğilime ters davranış sergiler.
Buna göre, X, Y ve Z bileşiklerindeki bu ters davra-
niş aşağıdaki etkileşimlerden hangisinden kaynakla-
nir?
A) Hidrojen bağı
-
B) Dipol-dipol etkileşimi
C) London etkileşimi
D) Kovalent bağ
E) İyonik bağ

Kimya
Kimyasal Türler ve Etkileşimleryukarıda
A) I ve II
angileri doğrudur?
B) I ve III
Cy1, Il ve Ill
E) Il ve III
Cilveli
D) Yalnız!
t
G
S
Elu
2
M
0
9.
C:
molekülü ile ilgili,
1.) Karbon ve oksijen atomları arasındaki etkileşim,
elektron ortaklaşması sonucu oluşur.
IV Lewis yapısı :0-c-Ö: şeklindedir.
IL
III. Yoğun fazda molekülleri arasında baskın olarak
London kuvvetleri bulunur.
yargılarından hangileri doğrudur? (6C, 80)
A) Yalnız!
B) I ve 11
D) Il ve III
ve III
EXI, II ve III
Calo
3

Kimya
Kimyasal Türler ve EtkileşimlerAYT/FEN BILIMLERİ
ise
30. Bit
ast
28. Canlılarda görülen hücresel solunum tepkimeleriyle ilgili
aşağıdaki açıklamalardan hangisi yanlıştır?
NAD gibi koenzimler, elektron ve hidrojeni son elektron
alıcısına taşır.
B)
Solunum sürecinde hem substrat düzeyinde hem de
oksidatif yolla ATP elde edilir.
ay
A)
B
u
C) Elektron taşıma sisteminde elektroların enerjisi düşürü-
lür.
D) Oksijensiz şartlarda meydana geldiğinde son elektron
alıcıları genellikle inorganiktir.
E) Krebs döngüsünde elde edilen ATP oksidatif yolla sağ-
E
Vanir.
31

Kimya
Kimyasal Türler ve Etkileşimler10. Aşağıda kimyasal türler arası etkileşimlerle ilgili bir etkinlik
verilmiştir.
Van der Waals etkileşimleri invalent
cağlardan daha güclüdür.
D
Moleküldeki elektron sayı
si arttıkça molekülün
polarlanabilirliği artar.
(D
Y
Suyun kaynaması
sırasında kovalent
bağlar kırılır.
D
Y
Dipol-di- Molekül içi
pol etkile-
bağları po-
şimleri, Lon- lar olan tüm
don kuvvet- maddelerin
leri ve hid-
yoğun fazda
rojen bağla- molekülleri
ri, Van der arasında di-
Waals bağ- pol-dipol et-
larının türle- kileşimleri
ridir.
oluşur.
Polar mo-
leküller ara-
sinda yo-
ğun fazlar-
da London
kuvvetleri
de bulunur.
İyonik bağ-
li bileşikler
apolar çö-
zücülerde,
polar çözü-
cülere göre
daha iyi çö-
zünür.
D
Y
D
Y
D
Y D
Y
2
3
4
5
6
8
Etkinlikteki ifadeleri doğru (D) ya da yanlış (Y) olarak
doğru bir şekilde değerlendiren bir öğrenci kaç numa-
raly çıkışa ulaşır?
A) 1
B) 2
C) 4
D) 5
E) 8

Kimya
Kimyasal Türler ve Etkileşimler....... CI
10.
1. Nat.
HO+
Hot
12
a
NaCl + H2O model gösterimi
& Hot
de Hot
8-
II.
Hot b
-NH0+..
'Hot
HO+ HO+
NH3 + H2O model gösterimi
Yukarıda tuzun sulu çözeltisi (1) ve amonyağın sulu çözeltisi
(11) model olarak gösterilmiştir.
Buradaki çözünme olayında etkin rol alan etkileşimler
a ve b hangi seçenekte doğru verilmiştir?
b
a
İyonik bağ
B) İyon - dipol-etkileşimi
G) İyon - dipol etkileşimi
D) Dipol-dipol bağı
E) Metalik
bağ
-
Hidrojen bağı
Dipol-dipol bağı
Hidrojen bağı
Hidrojen bağı
London kuvvetleri

Kimya
Kimyasal Türler ve Etkileşimler11. Atom numarası 16 olan X atomunun atom numarası 1
olan hidrojen (H) atomu ile oluşturduğu molekül için,
1. Apolardır.
II. Molekül şekli açısaldır.
III. X atomu sp hibritleşmesi yapmıştır.
3
yargılarından hangileri doğrudur?
A) Yalnız
B) Yalnız 11
C) I ve 11
D) II ve III
E) I, II ve III

Kimya
Kimyasal Türler ve Etkileşimler205
Aşağıdaki moleküllerin atomları arası bağın polar ya da apolar olma durumu ile moleküllerinin polar ya da
Etkinlik-8
apolar olma durumunu karşısındaki kutucuklara yazınız.
Etkinlik-10
Aşağıdaki tablo
ile belirtiniz.
Molekülün polarlığı lapolarlığı
Molekül
Atomlar arası bağın polarlığı / apolarlığı
M
H-ci:
-
F-
H
H-C-H
00: I-0-1
H
1/
:0
:o:
:I-1
Ñ
H
H
H

Kimya
Kimyasal Türler ve Etkileşimler3.
1. Sodyum oksit
II. Potasyum klorür
III. Hidrojen sülfür
Yukarıdaki bileşiklerin Lewis gösterimlerindeki nok-
ta sayılarının karşılaştırılması aşağıdakilerden hangi-
sinde doğru olarak verilmiştir?
(H, 80, 1, Na, 165,17CI, 19K)
A) III = || > 1
B) I > || > III
C) I = || = III
D) 1 = || > III
E) I = III > 11

Kimya
Kimyasal Türler ve EtkileşimlerKimya
Magnezyum bromür
Kükürt hekzaflorür
Bakır(II) oksit
Karbon disülfür
V.
Sodyum karbonat
Yukarıda sistematik adlandırması verilen bileşiklerden
hangileri iyonik bağlı bileşiktir?
A) I vet
B) II, IV ve V
C) III, IV ve V
DII ve IT
EI, H ve
obotni

Kimya
Kimyasal Türler ve Etkileşimler12.
10. Çekirdek için mavi ve elektronlar için kırmızı renk kullanı-
larak bazı elementlerin nötr atomlarının katman elektron
dağılımları modellenmiştir.
L
X,
rid
Bu
ci
ile
Na
t.
II.
ya
H
A)
Bu elementlerden oluşan NaCl ve H,0 bileşikleri ile
ilgili,
Fen
1. NaCl bileşiğindeki güçlü etkileşim iyonik bağdır.
H. A 0 molekülündeki H ve O atomları arasında elektron
ortaklaşması sonucunda hidrojen bağı oluşur.
1. Naci bileşiği H, O'da çözünürken iyon-indüklenmiş di-
pol etkileşimleri oluşur.
yargılarından hangileri doğrudur?
karekök
A) Yalnız!
B) Lve IT
DII ve II
C) I ve III
E) I, II ve III
13. Aş
ma

Kimya
Kimyasal Türler ve Etkileşimler10. Azot molekülleriyle (N2) ilgili,
I. Azot atomları arasındaki etkileşim, güçlü etkileşim
olarak sınıflandırılır.
II. Azot atomları arasındaki etkileşim, elektron
alışverişi sonucu oluşmuştur.
III. Azot molekülleri arasındaki etkileşim, London
kuvvetleri sonucu oluşmuştur.
ifadelerinden hangileri doğrudur? (7N) anfel omedel
A) Yalnız 11 B) Yalnız III C) Lve TT
D) I ve III
E) Il ve III

Kimya
Kimyasal Türler ve Etkileşimler2.
I. CH4
II. H2S
Dality
III. H2O
Yukarıda verilen bileşiklerle ilgili aşağıdaki ifadeler-
den hangisi yanlıştır? (H, 6C, 80, 165)
A) CH4 apolar bir moleküldür.
B) H2S molekülünde H ve S atomları arasında polar
kovalent bağ bulunur.
C) Kaynama noktası en yüksek olan CH4'tür.
D) Sıvı halde H2O molekülleri arasında etkin çekim kuv-
vetleri hidrojen bağlarıdır.
E) H2S gazı, H2O sivisi içinde çözünebilir.
H
SH

Kimya
Kimyasal Türler ve Etkileşimler10.
Molekül
formülü
Molekül
polarlığı
Moleküldeki
toplam
elektron
sayısı
Kaynama
noktası
(°C)
CHA
Apolar
10
-161
HO
Polar
10
100
CH
Apolar
18
-89
L 1:
Sadece tabloda verilen bilgilere göre,
I. Polar moleküllerin kaynama noktası apolar molekül-
lerden daha fazladır.
Apolar moleküllerde elektron sayısı arttıkça kayna-
ma noktası artar.) ordu
11I. Elektron sayısı aynı olan moleküllerin kaynama
noktaları da aynıdır.
sonuçlarından hangilerine ulaşılabilir?
B I ve II
Cytve III
D) Il ve II
E) LH ve III
A) Yalnız 1
19
